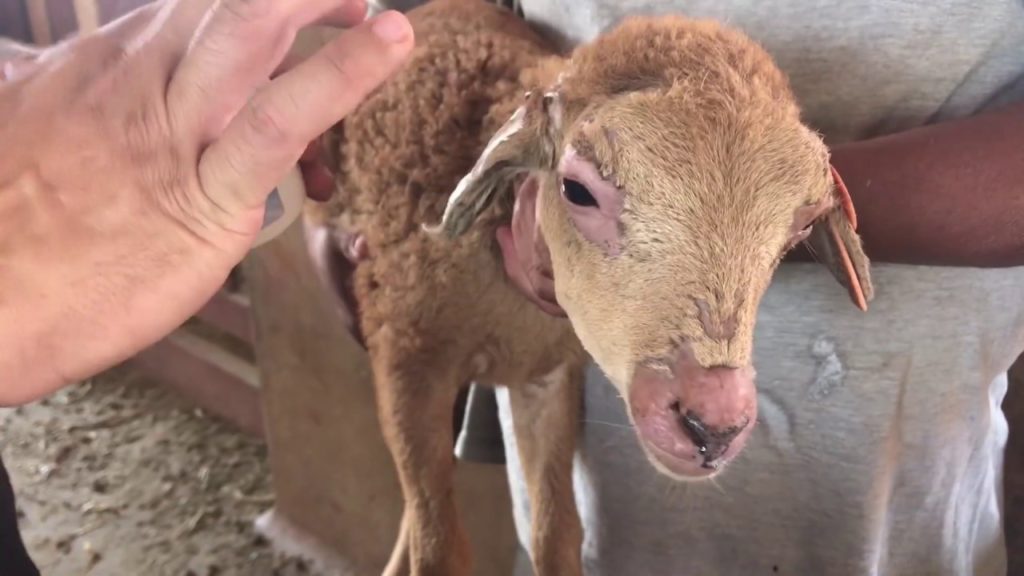
Muitos conhecem esse problema por requeima, mas ela também possui outros nomes como por exemplo: Fotossenssibilização; Intoxicação pela Brachiaria; Problema da braquiarinha, entre outros tão comum nas diversas regiões brasileiras. De antemão, já vamos deixar claro que o problema como um todo é uma intoxicação causada pela ingestão natural da Brachiaria spp.
Vamos fazer um passo a passo explicativo do porquê ela ocorre e como ela acomete o animal, assim como também vamos falar sobre o que é esse componente (que está naturalmente presente na forrageira) que causa o problema.
PLANTAS TÓXICAS E FATORES ANTI-NUTRICIONAIS
A seleção natural favoreceu, de alguma forma, plantas que em seus tecidos possuíam rotas bioquímicas que resultavam em produtos secundários. Metabolicamente, esses compostos não aparentam importância alguma, mas sob a ótica da co-evolução, resultados interessantes ocorreram. Apesar de não exercerem função aparente para o próprio metabolismo vegetal, os animais passaram a consumir menos ou rejeitar os vegetais produtores de compostos secundários, maximizando o sucesso reprodutivo dessas plantas (Lima Júnior, 2010).
Dessa forma, estabeleceu-se a defesa química como a conhecemos, presente na maioria das plantas atuais. A defesa química é uma das formas de proteção das plantas contra a herbivoria, o que envolve a elaboração e acumulação de substâncias orgânicas que, uma vez ingeridas, inibem o consumo (Lima Júnior, 2010).
As toxinas são, em geral, metabólitos secundários das plantas, isto é, substâncias químicas que não estão diretamente envolvidas no metabolismo fundamental da planta.
A maioria não contribui para o ganho de energia ou integridade estrutural. São extremamente diversas, apresentando uma grande variedade de tipos químicos, por vezes, a substância tóxica para o animal não é o composto em si, mas os metabólitos resultantes da sua degradação (Lima Júnior, 2010).
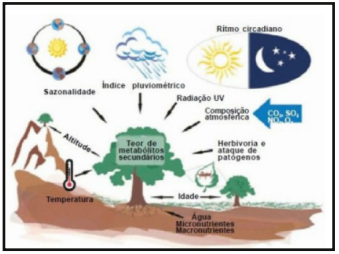
As proporções dos metabólitos podem variar com alterações (Figura 1) sazonais, circadianas, intra e interplanta, idade e desenvolvimento da planta, incluindo desenvolvimento foliar, surgimento e novos órgãos, processos bioquímicos, fisiológicos, ecológicos e evolutivos. Temperatura, altitude, índice pluviométrico, radiação UV (Ultravioleta), poluição atmosférica, disponibilidade de nutrientes e água no solo, herbivoria e ataque de patógenos são outros fatores que influenciam no metabolismo secundário (Czelusniak et al., 2012).
INTOXICAÇÃO POR BRACHIARIA SPP
A intoxicação por Brachiaria spp. tornou-se um dos maiores entraves à expansão da ovinocultura nas áreas da região Centro-Oeste (Porto et al., 2013), devido aos casos de fotossensibilização associadas a esta forrageira (Riet-Correa et al., 2011).
A fotossensibilização é uma demartite caracterizada por uma sensibilidade extrema do animal aos raios solares (Riet-Correa e Medeiros, 2001) que causa perdas econômicas por parte dos animais e, principalmente por menor ganho ou perda de peso (Mustafa et al. 2012).
Inicialmente, considerou-se que a fotossensibilização causada pela Brachiaria spp. era devida à presença do fungo Pithomyces chartarum (Döbereiner et al. 1976; Fioravanti 1999), produtor da toxina esporodesmina, mas posteriormente determinou-se que a grande maioria das cepas deste fungo estudadas no Brasil não são produtoras desta toxina (Lemos et al., 1996a; Riet-Correa e Medeiros, 2001; Cruz et al., 2001). Além disso, as alterações histopatológicas encontradas nos animais intoxicados por Brachiaria spp. no Brasil são diferentes das alterações causadas pela esporidesmina (Tokarnia et al. 2000, Riet-Correa e Méndez. 2011).
Leia também: O que é fotossensibilização?
Hoje sabe-se que a toxicidade para animais em pastagens de Brachiaria spp. é atribuída à presença de saponinas esteroidais litogênicas na própria gramínea (Smith e Magdasian 1993; Lemos et al. 1997).
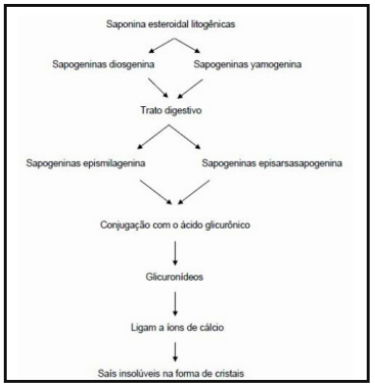
As saponinas esteroidais litogênicas são glicosídeos que contém uma ou várias cadeias de açúcares e que recebem este nome por sua característica de formar uma espuma persistente e abundante quando em contato com soluções aquosas (Santos et al., 2008). A hidrólise dos açúcares das saponinas pelo metabolismo ruminal origina as sapogeninas epismilagenina e episarsasapogenina (Figura 2) que, após conjugação com o ácido glicurônico, ligam-se aos íons de cálcio e formam sais insolúveis que se precipitam nos ductos biliares na forma de cristais (Cruz et al., 2001; Santos et al., 2008; Santos Júnior, 2008; Gracindo, 2010). Esses cristais, por sua vez, podem causar inflamação e obstrução do sistema biliar além de necrose dos hepatócitos periportais, resultando em icterícia, fotossensibilização e hepatite (Santos et al., 2008).
O princípio tóxico da Brachiaria spp. é um componente da própria planta, identificado como sendo uma saponina litogênica, chamada de protodioscina, que causa hepatotoxicidade (Lemos et al., 1997; Brum et al., 2007; Santos Júnior, 2008).
O QUE É PROTODIOSCINA (SAPONINA)?
As saponinas são substâncias derivadas do metabolismo secundário das plantas, relacionadas com o sistema de defesa (Lima Junior et al., 2010), e encontradas nos tecidos que são mais vulneráveis ao ataque fúngico, bacteriano ou predatório dos insetos (Wina et al., 2005). Nas plantas, ocorrem em partes diferentes, tais como: raízes, folhas e sementes. As saponinas triterpênicas são encontradas principalmente nas dicotiledôneas, enquanto as saponinas esteroidais, ocorrem nas monocotiledôneas, categoria que abrange as gramíneas (Schenkel et al., 2007).
Seu nome deriva da propriedade mais característica desse grupo de compostos, que é a formação de espuma persistente e abundante quando em solução aquosa (Albernaz, 2009). Apresentam comportamento anfifílico, ou seja, são compostos que apresentam na mesma molécula uma parte apolar (hidrofóbica) e uma parte polar (hidrofílica) sendo capaz de promover a interação entre meios que apresentam polaridade diferente (por exemplo água e óleo), neste sentido, apresentam potencial de formar complexos com esteroides, proteínas e fosfolipídieos de membranas. Desse modo, determinam várias propriedades biológicas, destacando-se a ação sobre as membranas celulares, alterando sua permeabilidade, ou causando sua destruição (Wina et al., 2005).
As saponinas esteroidais litogênicas presentes nas forrageiras causam, entre outras alterações, formação de material cristalóide em ductos biliares e interferência no metabolismo de hepatócitos (Santos Júnior et al., 2008). Essas alterações promovem a obstrução dos ductos biliares, seguida de acúmulo de filoeritrina na circulação e nos tecidos, causando fotossensibilização (Santos Júnior et al., 2008).
Níveis de saponina (protodioscina) foram mensurados por Mustafa et al. (2012) os quais relataram a determinação em cinco das 11 propriedades acompanhadas, três delas ocorreram no período da seca (S1 = 0,30%, S2 = 1,06% e S8 = 0,80%), e as outras no período chuvoso (S5 = 2,56% e S6 = 1,29%). No período das chuvas, os piquetes se encontravam em brotação e com níveis mais elevados de protodioscina que as amostras do período da seca, onde o capim se apresentava em sementação ou em fase de queda de sementes. Na propriedade (S1) onde o nível de saponina foi mais baixo, a morbidade foi de 6,6% e nenhum animal morreu. Em contraste a esta, a propriedade (S5) apresentou o nível mais elevado de saponina (2,56%), registrando a intoxicação natural por Brachiaria spp. de um animal adulto, e na propriedade (S6), com o segundo maior nível de saponina nas amostras de capim, observou-se elevada letalidade (60%) dos animais intoxicados.
Níveis de protodioscina, variando de 0,52% a 1,06%, foram encontrados em pastagem madura de Brachiaria decumbens na fase final de sementação, capaz de intoxicar e provocar a morte de ovinos jovens (Castro et al. 2011). Experimentalmente, piquetes em estágio de brotação, crescimento e maduro apresentaram respectivamente 2,03%, 1,63% e 1,26% de saponina na constituição da forrageira, correspondendo a maior toxicidade para ovinos nas amostras com maior quantidade do princípio tóxico (Santos Júnior, 2008). Essa observação foi posteriormente demonstrada em amostras de Brachiaria brizantha que apresentaram maior concentração de saponina nas plantas jovens (3,61% ± 1,12%) em relação ao capim maduro (1,01% ± 0,79%) (Ferreira et al. 2011). No Brasil, ainda há poucos estudos de intoxicação por braquiária em ruminantes com a mensuração dos níveis de saponina nas pastagens. De qualquer forma, essas informações retratam uma amplitude muito grande nos níveis presentes nas pastagens que são suficientes para provocar intoxicação em ovinos. Esta espécie, considerada uma das mais suscetíveis à intoxicação por braquiária, pode adoecer mesmo com baixos níveis de protodioscina na forrageira (Mustafa et al., 2012).
COMO OCORRE A INTOXICAÇÃO POR BRACHIARIA SPP.
As gramíneas do gênero Brachiaria spp., de modo geral, apresentam lenta taxa de passagem pelo trato gastrintestinal e baixa degradação da fibra (Detmann et al., 2001), resultando consequentemente em baixo consumo voluntário e aumento do tempo de pastejo (Silva et al., 2009). Alimentos que apresentam partículas maiores aumentam o tempo de retenção no rúmen – provavelmente os microrganismos têm maior tempo para a degradação da saponina, acarretando em lesões hepáticas.
As saponinas parecem não promover destruição das bactérias do rúmen. Sua ação sobre o colesterol e esteroides de membrana se aplica a todas as células, exceto as procariotas (bactérias) que não possuem tais componentes de membrana. Entretanto, as saponinas conseguem inibir o crescimento de bactérias gram-positivas da flora ruminal, devido à ação semelhante dos ionóforos, alterando a tensão superficial da matriz extracelular (Cheeke, 1999). Estas são degradadas pela microbiota ruminal em seus derivados, as sapogeninas.
Acesse também nosso LinkedIn e nos siga: Zootecnia Brasil
As sapogeninas são transportadas ao longo do tubo digestivo e eliminadas nas fezes, mas algumas são absorvidas no duodeno e transportadas até o fígado, onde são conjugadas com a bile e eliminadas (Wina et al., 2005).
Quando há disfunção hepatocelular ou obstrução biliar, a filoeritrina (é um produto de reações pela qual a clorofila participa, é um pigmento) se acumula na circulação sanguínea e se deposita no tecido subcutâneo (McGavin e Zachary, 2013). Uma vez o pigmento depositado no tecido, quando exposto a radiação ultravioleta solar de onda longa, é absorvido pela pele que resulta na liberação de energia a qual produz moléculas reativas de oxigênio, inclusive radicais livres. A geração destas moléculas reativas, leva a degranulação de mastócitos e à produção de mediadores inflamatórios, causando danos as membranas celulares, ácidos nucleicos, proteínas e organelas celulares (McGavin e Zachary, 2013). Estas alterações causam inflamação, intensa irritação e consequente edema que progride para necrose e gangrena de extremidades nos estágios finais da lesão (Radostits et al. 2007, Smith e Magdesian 1993).
Em média, após duas semanas do início dos sinais clínicos, registra-se morte dos animais, segundo estudo realizado por Albernaz et al. (2010) onde, dos 80 cordeiros avaliados, 13 adoeceram e 10 morreram. Apresentando taxas de morbidade e letalidade de 16,3% e 76,9%, respectivamente. O que demonstra alta letalidade após intoxicação.
TIPOS DE INTOXICAÇÃO POR BRACHIARIA SPP
Basicamente, são descritos dois tipos de fotossensibilização, ambas relacionadas à presença do agente fotossensibilizador na corrente sanguínea (Macedo et al., 2006; Albernaz et al., 2010).
Tipo I ou primária: os agentes fotodinâmicos exógenos (Schild, 2007) são absorvidos pela mucosa intestinal, atravessam a barreira hepática, caem na circulação sanguínea e alcançam a pele, onde ocorre uma indução excessiva aos raios solares, ou seja, é caracterizada pela ingestão de compostos fotodinâmicos pré-formados (Yager e Scott, 2003).
Tipo II ou secundária (hepatotóxica): nesta o processo é mais complexo, a Brachiaria spp. possui uma substância tóxica que provoca alterações no parênquima hepático ou nos ductos biliares com perturbações no mecanismo de eliminação da filoeritrina (Albernaz, 2009), ou seja, ocorre um bloqueio físico do fluxo da bile, que dificulta a metabolização e excreção da filoeritrina, substância fotodinâmica oriunda da quebra da clorofila no rúmen, que se acumula no sangue e nos tecidos (Anderson et al., 2004; Górniak, 2008; Santos et al., 2008).
A filoeritrina é um pigmento fluorescente formado nos pré-estômagos dos ruminantes, a partir da clorofila (Albernaz, 2009), pela ação das bactérias e protozoários ruminais (Kozloski, 2009). Em pequena escala a filoeritrina absorvida pela mucosa intestinal e em condições normais, é eliminada do fígado através da bile.
Nos casos de fotossensibilização secundária, a lesão hepática perturba esse mecanismo fazendo com que a filoeritrina passe à circulação sistêmica e se deposite na pele onde quando exposta a radiação ultravioleta, causa ruptura dos queratinócitos e destruição tecidual (Glenn, et al., 1964; Stelgelmeier, 2002; Albernaz, 2009).
SINAIS CLÍNICOS
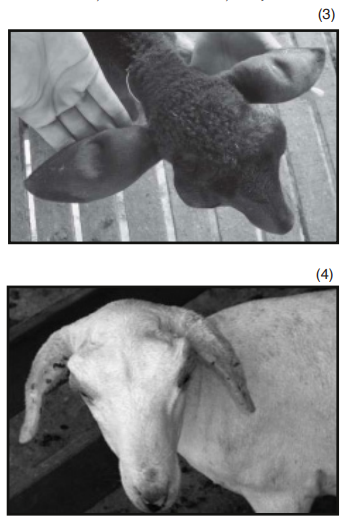
Dentre os principais sinais clínicos observados na intoxicação de ovinos pela Brachiaria spp, segundo Purisco e Lemos (2002), destaca-se a fotossensibilização, caracterizada por edema de face e orelhas (Figura 3 e 4), lesões eritematosas, com presença de crostas em regiões despigmentadas da pele ou desprovidas de pelos mais expostas ao sol (Figura 5). Além de icterícia (Figura 6), fotofobia, apatia, diminuição do apetite e emagrecimento, aumento significativo nos níveis de GGT (gama – glutamiltransferase) e AST (aspartoaminotransferase), secreção ocular e nasal serosa e purulenta, hiperemia ocular, prurido, inquietação e preferência por áreas sombreadas (Figura 7).
O edema de face e orelha, assim como o eczema facial, vem sendo descritos caracteristicamente e exclusivamente em ovinos intoxicados pela forrageira (Sallan Abdulla et al., 1992).
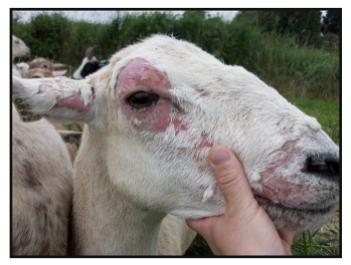
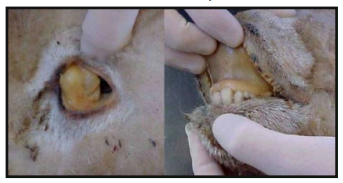
spp. apresentando icterícia (Google imagens – fonte desconhecida)

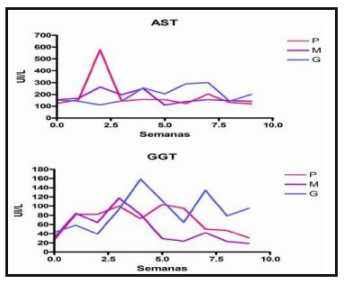
A análise das enzimas séricas AST e GGT é um importante parâmetro a ser observado nos casos de intoxicação pela Brachiaria spp. A AST é uma enzima encontrada no citoplasma e na mitocôndria dos hepatócitos, em lesões hepáticas agudas ou crônicas, os níveis desta enzima tendem a se elevar na circulação (Tennant, 1997). A GGT está presente na membrana plasmática de células do epitélio dos ductos biliares e seus níveis elevados na circulação são observados em lesões hepáticas (Tennant, 1997).
Ovinos mantidos em pastagem de Brachiaria decumbens, com três diferentes dias de crescimento (P – 15; M – 45; G – 90 dias), avaliados por Santos Júnior (2008), demonstraram que as elevações mais precoces de AST e GGT no grupo “P – 15 dias” e “M – 45 dias” (Figura 8), coincidiram com a maior rapidez que os ovinos adoeceram e morreram. Sendo importante ressaltar que os grupos de ovinos eram homogêneos, o que sugere fortes evidencias de que as alterações enzimáticas dos grupos “P” e “M” foram decorrentes a maior toxicidade destas pastagens em relação ao grupo “G”. No entanto, a elevação destas enzimas nem sempre se refletiram em sinais clínicos da intoxicação.
PERÍODO DE MAIOR INCIDÊNCIA E CATEGORIAS MAIS SUSCEPTÍVEIS
O efeito tóxico das plantas não é constante e uniforme, sendo afetado por diversos fatores como condições de administração ou épocas do ano (Castro et al., 2007; Santos Júnior et al., 2008; Riet-Correa et al., 2011), e a quantidade de saponina pode variar na mesma espécie forrageira devido a vários fatores, tais como estresse ambiental, idade da planta e sua fase de desenvolvimento (Oleszek, 2002). No Centro-Oeste vários surtos vêm sendo descritos em ovinos no início do período chuvoso, porém os fatores envolvidos são pouco conhecidos (Castro et al., 2007).
Níveis distintos de saponina entre as Brachiaria brizantha e Brachiaria decumbens foram encontrados por Brum et al. (2009) em diferentes estágios de desenvolvimento, sendo de 0,53% e de 2,09% respectivamente. Ainda segundo os autores, os níveis de saponina na Brachiaria brizantha e na Brachiaria decumbens foram maiores durante a maturação da planta, sugerindo maior toxicidade nessa fase de desenvolvimento.
Alguns relatos descrevem a ocorrência de fotossensibilização em pastos de Brachiaria spp. vedados por longos períodos. Outra situação observada é a ocorrência do problema no final da estação seca, agravando-se seriamente com o surgimento de vários casos após as primeiras chuvas, coincidindo com a brotação da pastagem (Purisco e Lemos, 2002).
Maiores quantidades de saponina foram verificadas por Albernaz et al. (2010) no capim Brachiaria brizantha no período seco, o que está de acordo com o observado por Souza et al. (2006), e com o capim em fase de maturação, como demonstrado por Brum et al. (2009). Nessa época, o capim se encontrava com poucos centímetros de altura e o pastejo era intensivo, diferente do observado por Brum et al. (2004), que verificaram que nessas condições o capim é menos tóxico para ovinos.
Geralmente, a concentração de saponina é maior nas plantas em crescimento e períodos chuvosos, mas é importante ressaltar que surtos ocorrem durante o ano todo, provavelmente por aumento da concentração de saponina nas plantas por alguma causa ainda desconhecida (Santos Junior et al., 2008; Saturnino et al., 2010; Riet-Correa et al., 2011).
Animais introduzidos pela primeira vez em pastagens de Brachiaria spp. são mais susceptíveis à intoxicação, não se sabe se a maior resistência é devido a algum mecanismo de adaptação ou se ao longo do tempo houve seleção natural de animais resistentes (Riet-Correa et al., 2006). Propõem-se, também, que alguns ovinos são resilientes, ou seja, animais intoxicados que apresentam lesões histológicas e elevação nos níveis de AST e GGT, mas não apresentam sinais clínicos (Riet-Correa et al., 2011).
Foram avaliados por Santos Junior (2009), 21 ovinos, divididos em três lotes (dias de crescimento da forrageira, P-15; M-45 e G-90 dias) contendo 7 animais em cada tratamento, e registrou-se 12 animais intoxicados durante o período experimental (5 do grupo P; 4 do grupo M e 3 do grupo G), demonstrando a toxicidade da planta em qualquer época do crescimento vegetativo. Mas deve-se ressaltar que os níveis de saponina estavam significativamente maiores na pastagem P (brotação), coincidindo com o surgimento dos sinais clínicos mais severos, além da maior taxa de morbidade (71,43% dos 21 animais foram intoxicados (12)) e de mortalidade (44,44% dos 12 intoxicados, 9 morreram).
Assim pressupõe-se que, para que haja intoxicação por Brachiaria spp. em ovinos, não é necessária grande quantidade da toxina, pois esta espécie é considerada altamente sensível (Brum, 2006). A ingestão durante a fase de brotação ou pastos fechados por mais de um mês está relacionada com maior toxicidade, acometendo animais de todas as idades (Riet-Correa et al., 2006) – porém, os animais mais jovens demonstram maior sensibilidade que os adultos (Castro et al., 2007; Santos et al., 2008; Castro et al., 2011).
Ressaltando que a intoxicação pode ocorrer também em animais lactentes, com menos de trinta dias de idade (Lemos et al. 1996b), o que sugere que as saponinas esteroidais, presentes nesta planta, são também excretadas em quantidades tóxicas pelo leite (Lemos et al. 1998).
Até o momento, os mecanismos envolvidos nesta maior susceptibilidade de animais jovens são desconhecidos, porém, o fato de ocorrerem menos casos de intoxicação em ovinos adultos, sugere a existência de alguma forma de adaptação ou resistência adquirida dos animais à toxicidade das pastagens (Mustafa et al., 2012).
TRATAMENTO E PREVENÇÃO
Uma investigação sobre a intoxicação natural por Brachiaria spp. em ovinos foi realizada no Brasil Central por Mustafa et al. (2012) os quais relataram que os resultados observados e comparados aos surtos descritos no Brasil, demonstram que a intoxicação por Brachiaria spp. em ovinos, na maioria das vezes, é caracterizada por elevada mortalidade, morbidade e letalidade, expondo de forma inequívoca os prejuízos que a gramínea pode provocar nos plantéis de todo país. O tratamento não é eficaz em casos graves, podendo-se utilizar corticoides (dexametasona) e soro glicosado com resultados variáveis (Borges et al. 2009).
A suplementação pode ser usada como alternativa para acelerar o desempenho dos animais (Silva et al., 2009) e diminuir os efeitos da fotossensibilização. Quando os animais têm à disposição forragem à vontade e recebem concentrado, dois efeitos, denominados aditivo e substitutivo (Goes et al., 2004) poderão ocorrer. O efeito aditivo pode ser avaliado pelo consumo total de matéria seca (pasto + suplemento) e do ganho de peso dos animais e o substitutivo pela redução no consumo de forragem, com aumento ou mesmo redução em desempenho (Silva et al., 2009). A inclusão de alimento concentrado na dieta altera o pH ruminal, consequentemente os produtos finais da fermentação e a taxa de crescimento dos microrganismos ruminais, devido à rápida taxa de fermentação ocasionada pela dieta (Homem Júnior et al., 2010). Portanto, a suplementação concentrada reduz o tempo médio de retenção total de alimento no rúmen (Detmann et al., 2001) e, dessa forma, a degradação da saponina decresce em função da mudança da microbiota ruminal e da rápida taxa de passagem no rúmen.
Outra alternativa seria a utilização de programas de seleção para a obtenção de variedades de forrageiras não tóxicas (ou menos tóxicas) para se obter exemplares com baixo conteúdo de saponinas litogênicas, ou então a substituição por espécies não tóxicas ou menos tóxicss de Brachiaria spp. com similar produtividade (Riet-Correa e Medeiros, 2001).
Entretanto, em uma forma prática, aos primeiros sintomas deve-se retirar os animais do pastejo direto e da exposição solar, colocando-os em local protegido do sol, com disposição de água para consumo a vontade e uma alimentação alternativa a Brachiaria spp. Nas lesões cutâneas podem ser aplicadas pastas (pomadas) a base de óxido de zinco e nos casos mais graves é importante evitar a ocorrência de infecções secundárias e miíases (bicheira).
Uma avaliação com 26 ovinos, divididos em três grupos (GS – exposição solar; GSB – Protegidos do sol; GC – Grupo controle) foi realizada por Saturnino et al. (2010) e observou-se que a não exposição ao sol não evita a presença de sinais clínicos da intoxicação, mas que a exposição solar exacerba os sinais clínicos, ou seja, o efeito tóxico da gramínea acontece independente do animal estar exposto ou não ao sol, portanto, não necessariamente associado ao fenômeno de fotossensibilização.
Outro aspecto importante a ser considerado no controle das intoxicações por plantas na América do Sul é o desenvolvimento de bons sistemas de informação sobre a ocorrência das enfermidades, incluindo as intoxicações por plantas, nos animais domésticos. Devemos procurar, também, obter informações sobre a fenologia das plantas tóxicas mais importantes. O conhecimento do ciclo biológico das plantas e as variáveis que o determinam é fundamental para utilizar práticas adequadas de manejo que possam prevenir as intoxicações (Riet-Correa e Medeiros, 2001) ou para a aplicação de algumas técnicas mencionadas anteriormente.
A intoxicação por Brachiaria spp. em ovinos é uma importante causa de perdas econômicas no Brasil (Riet-Correa e Medeiros, 2001; Castro et al., 2007). No entanto, as gramíneas do gênero Brachiaria spp., de modo geral, apresentam lenta taxa de passagem pelo trato gastrintestinal e baixa digestibilidade da fibra, resultando consequentemente em baixo consumo voluntário (Silva et al., 2009).
Este material é parte da tese de Marlova Cristina Mioto da Costa (http://lattes.cnpq.br/4439095919963924). Possui experimento realizado em Campo Grande – Mato Grosso do Sul, com publicações em:
Capitulo de livro – AGRICULTURA EM FOCO: Tópicos Em Manejo, Fertilidade do Solo e Impactos Ambientais – Volume 2. Para ler na íntegra acesse: https://downloads.editoracientifica.org/articles/200600417.pdf
Artigo – Tropical Animal Health and Production disponível em – https://link.springer.com/article/10.1007%2Fs11250-021-02775-3
Referências:
ALBERNAZ, T.T. Fotossensibilização em ovinos associada à ingestão de Brachiaria rizantha no estado do Pará. 2009. 50f. Dissertação (Mestrado em Ciência Animal) – 533 Universidade Federal do Pará/Universidade Federal Rural do Amazônia, Amazônia Oriental.
ANDERSON, D. E.; RINGS, D. M.; PUGH, D. G. Enfermidades do sistema tegumentar. In: PUGH, D. G. Clínica de ovinos e caprinos. 1. ed. São Paulo: Roca, 2004.
BORGES, J. R. J.; GODOY, R. F.; XIMENES, F. B.; CASTRO, M. B.; MUSTAFA, V.; RECKZIEGEL, G.; NOVAIS, E. P. F. Doenças hepáticas em ovinos e caprinos. Ciência Animal Brasileira, v. 0, n.0, p. 1-11, 2009.
BRUM, K.B., HARAGUCHI, M., GARUTTI, M.B., NÓBREGO, F.N., ROSA, B. e FIORAVANTE, M.C. Análise semiquantitativa da saponina protodioscina do ciclo vegetativo de Brachiaria decumbens. Pesquisa Veterinária Brasileira, v. 24(Supl.), p.13-14, 2004.
BRUM, K.B.; HARAGUCHI, M.; GARUTTI, M.B.; NOBREGA, F. N.; ROSA, B.; FIORAVANTI, M. C. S. Steroidal saponin concentrations in Brachiaria decumbens and B. brizantha at different developmental stages. Ciência Rural, v.39, n.1, p.279-281, 2009
BRUM, K.B.; HARAGUCHI, M.; LEMOS, R.A.A.; RIET-CORREA, F.; FIORAVANTI, M.C.S. Crystal-associated cholangiopathy in sheep grazing Brachiaria de cumbens containing the saponin protodioscin. Pesquisa Veterinária Brasileira. v. 27, p.39-42, 2007.
CASTRO, M.B., SANTOS JÚNIOR, H.L., MUSTAFA, V.S., GRACINDO, C.V., MOSCARDINI, A.C.R., LOUVANDINI, H., PALUDO, G.R., BORGES, J.R.J., HARAGUCHI, M., FERREIRA, M.B. e RIET-CORREA, F. 2011. Brachiaria spp. poisoning in sheep in Brazil. Experimental and epidemiological findings, p.110-117. In: Riet- -Correa F., Pfister J., Schild A.L. e Wierenga T. (Eds), Poisoning by Plants,Mycotoxins and related Toxins. CAB International, London.
CHEEKE, P. R. 1999. Actual and potential applications of Yucca schidigera and Quillaja saponaria saponins in human and animal nutrition. In: AMERICAN SOCIETY OF ANIMAL SCIENCE, 1999. Indianapolis, Proceedings… Indianapolis: ASAS, p.1-10.
CRUZ, C.; DRIEMEIER, D.; PIRES, V.S.; SCHENKEL, E.P. Experimentally induced cholangiohepatopathy by dosing sheep with fractionated extracts from Brachiaria decumbens. Journal of Veterinary Diagnostic Investigation, v. 13, n. 2, p. 170-172, 2001.
CZELUSNIAK, K. E.; BROCCO, A.; PEREIRA, D. F.; FREITAS, G. B. L. Farmacobotânica, fitoquímica e farmacologia do Guaco: revisão considerando Mikania glomerata Sprengel e Mikania laevigata Schulyz Bip. Ex Baker. Revista Brasileira de Plantas Medicinais, v. 14, n. 2, p. 400-409, 2012.
DETMANN, E.; PAULINO, M.F.; ZERVOUDAKIS, J.T.; VALADARES FILHO, S. C.; LANA, R. P.; QUEIROZ, D. S. Suplementação de novilhos mestiços durante a época das águas: Parâmetros ingestivos e digestivos. Revista Brasileira de Zootecnia, v.30, n.4, p.1340-1349, 2001.
DÖBEREINER, J.; TOKARNIA, C.H.; MONTEIRO, M.C.C.; CRUZ, L.C.H.; CARVALHO, E.G.; PRIMO, A.T. Intoxicação de bovinos e ovinos em pastos de Brachiaria decumbens contaminados por Pithomyces chartarum. Pesquisa Agropecuária Brasileira, Série Veterinária, v.11, p.87-94, 1976.
FERREIRA, M.B.; BRUM, K.B.; FERNANDES, C.E.S.; MARTINS, C.F.; MONTEIRO, L.C.; REZENDE, K.G.; RIET-CORREA, F.; HARAGUCHI, M.; WYSOCKI, Junior H.L.; LEMOS, R.A.A. 2011. Variations of saponin level x maturation in Brachiaria brizantha leaves, p.118-123. In: Riet-Correa F., Pfister J., Schild A.L. & Wierenga T. (Eds), Poisoning by Plants, Mycotoxins and related Toxins. CAB International, London.
FIORAVANTE, M.C. Incidência, avaliação clínica, laboratorial e anatomopatológica a intoxicação subclínica por esporidesmina em bovinos. 1999. 93p Tese de Doutorado em Medicina Veterinária, Faculdade de Medicina Veterinária e Zootecnia, Unesp, Botucatu, SP.
GLENN, B.L.; MONLUX, A.W.; PANCIERA, R.J. A hepatogenous photosensitivity disease of cattle: I. Experimental Production and clinical aspects of the disease. Veterinary Pathology, v.1, p.469-484, 1964.
GOBBO-NETO, L.; LOPES, N.P. Plantas medicinais: fatores de influência no conteúdo de metabólitos secundários. Química Nova, v.30, n.2, p.374-81, 2007.
GOES, R.H.T.B.; ALVES, D.D.; MANCIO, A.B.; ZERVOUDAKIS, J. T. Efeito associativo da suplementação de bovinos a pasto: revisão. Arquivo Ciência Veterinária Zoologia, v.7, n.2, p.163-169, 2004.
GÓRNIAK, S.L. Plantas Tóxicas de Interesse Agropecuário. In: SPINOSA, H. DE S.; GÓRNIAK, S.L.; PALERMO NETO, J. Toxicologia aplicada à medicina veterinária. 1ed. São Paulo: Manole, 2008. v. 1, cap. 15, p. 415-458.
GRACINDO, C.V. Avaliação do desempenho e da toxicidade em ovinos mantidos em pastagens de Brachiaria decumbens, Brachiaria brizantha, Panicum maximum var Aires e Andropogon gayanus var Planaltina. 2010. 90 p. Dissertação (Mestrado em Saúde Animal) – Faculdade de Agronomia e Medicina Veterinária, Universidade de Brasília, Brasília, 2010.
KOZLOSKI, G.V. Bioquímica dos ruminantes. Santa Maria: UFSM, 2009. 214p.
LEMOS R.A.A., NAKAZATO, L. e POZO Del C.F. 1998. Intoxicação por Brachiaria sp, p. 299-306. In: Lemos R.A.A. (ed.) Principais Enfermidades de Bovinos de Corte do Mato Grosso do Sul. Universidade Federal do Mato Grosso do Sul, Campo Grande.
LEMOS, R. A. A.; FERREIRA, L. C. L.; SILVA, S. M.; NAKAZATO, L.; SALVADOR, S. C. Fotossensibilização e colangiopatia associada a cristais em ovinos em pastagem com Brachiaria decumbens. Ciência Rural. Santa Maria, v. 26, p. 109-113, Jan./Apr. 1996a.
LEMOS, R.A.A.; FERREIRA, L.C.L.; SALVADOR, S.C.; NAKAZATO, L. Fotossensibilização e colangiopatia associada a cristais em bovinos mantidos em pastagens de Brachiaria decumbens no Mato Grosso do Sul. Anais… 1º Encontro de Laboratórios de Diagnóstico Veterinário do Cone Sul, Campo Grande, MS, p.41-43, 1996b.
LEMOS, R.A.A.; SALVADOR, S.C.; NAKAZATO, L. Photosensitization and crystal associated cholangiohepatopathy in cattle grazing Brachiaria decumbens in Brazil. Veterinary Human Toxicology v.39, p.376-377, 1997.
LIMA JÚNIOR, D.M.; MONTEIRO, P.B.S.; RANGEL, A.H.N. MACIEL, M. V.; OLIVEIRA, S. E. O.; FREIRE, D. A. Fatores anti-nutricionais para ruminantes. Acta Veterinaria Brasilica, v.33, n.4, p.132-143, 2010.
MACEDO, M.F.; BEZERRA, M.B.; BLANCO, B.S. Fotossensibilização em animais de produção na região semi-árida do Rio Grande do Norte. Arquivos do Instituto Biológico, .73, n.2, p.251-254, 2006.
McGAVIN, M. D.; ZACHARY, J. F. Bases da patologia em veterinária: 5 ed. Rio de Janeiro: Editora Elsevier, 2013.
MUSTAFA, V.S.; MOSCARDINI, A.R.C.; BORGES, J.R.J.; RECKZIEGEL, G. C.; RIET-CORREA, F.; CASTRO, M. B. Intoxicação natural por Brachiaria spp. em ovinos no Brasil Central. Pesquisa Veterinária Brasileira, v.32, n.12, p.1272-1280, 2012.
OLESZEK, W.A. Chromatografic determination of plants saponins. Journal of Chromatografy A, v.967, p.147-162, 2002.
PORTO, M.R.; SATURNINO, K.C.; LIMA, E.M.M. LEE, S. T.; LEMOS, R. A. A.; PEREIRA-MARCOLONGO, C.; RIET-CORREA, F. CASTRO, M. B. Avaliação da exposição solar na intoxicação experimental por Brachiaria decumbens em ovinos.
PURISCO, E.; LEMOS, R.A.A. Plantas que causam fotossensibilização hepatógena. In: LEMOS, R.A.A.; BARROS, N.; BRUM, K.B. Enfermidades de interesse econômico em Bovinos de Corte – Perguntas e respostas. Campo Grande:UFMS, 2002. 147p.
RADOSTITS, O.M., GAY, C.C., HINCHCLIFF, K.W.; CONSTABLE, P.D. Veterinary Medicine: A textbook of the diseases of cattle, horses, sheep, pigs, and goats. 10th ed. Saunders Elsevier, Edinburgh, 2007.
RIET-CORREA, B.; CASTRO, M.B.; LEMOS, R. A. A., RIET-CORREA G., MUSTAFA V.; RIET- -CORREA F. Brachiaria spp. poisoning of ruminants in Brazil. Pesquisa Veterinária Brasileira, v. 31, n. 3, p. 183-192, 2011.
RIET-CORREA, F.; MEDEIROS, R.M. Intoxicação por plantas no Brasil e no Uruguai: importância econômica, controle e riscos para a Saúde Pública. Pesquisa Veterinária Brasileira, v.21, p.38-42, 2001.
SALLAM ABDULLAH, A.; LAJIS, N. H.; BREMNER, J. B.; DAVIES, N. W.; MUSTAPHA, W.; RAJION, M. A. Decumbens Intoxicated Sheep. Veterinary and Human Toxico. v. 34, p. 154- 155, 1992.
SANTOS JÚNIOR, C.A.; RIET-CORREA, F.; SIMÕES, S.V.D.; BARROS, C. L. Patogênese, sinais clínicos e patologia das doenças causadas por plantas hepatotóxicas em ruminantes e equinos no Brasil. Pesquisa Veterinária Brasileira, v.28, n.1, p.1-14, 2008.
SANTOS JÚNIOR, H. L. Estudo da Toxicidade de Diferentes Estágios de Crescimento da Brachiaria decumbens em Ovinos. 2008. 65 p. Dissertação (Mestrado em Saúde Animal) – Faculdade de Agronomia e Medicina Veterinária, Universidade de Brasília, Brasília, 2008.
SATURNINO, K.C.; MARIANI, T. M.; BARBOSA-FERREIRA, M., BRUM, K. B.; FERNANDES, C. E. S., LEMOS, R. A. A. Intoxicação experimental por Brachiaria decumbens em ovinos confinados. Pesquisa Veterinária Brasileira, v. 30, n.3, p. 195-202, 2010.
SCHENKEL, E.P.; GOSMAN, G.; ATHAYDE, M.L. Saponinas. In: SIMÕES, C.M.O.; SCHENKEL, E.P.; GOSMAN, G. et al. (Ed.) Farmacognosia: da planta ao medicamento. 6.ed. Porto Alegre: URRGS; Florianópolis: UFSC, 2007. p.711-740.
SCHILD, A.L. Fotossensibilização hepatógena. In: RIET-CORREA, F.; SCHILD, A.L.; LEMOS, R.A.A. et al. (Ed) Doenças de Ruminantes e Equídeos. 3.ed. Pallotti:Fernovi, 2007. p.39-42.
SILVA, F.F.; SÁ, J.F.; SCHIO, A.R. ÍTAVO, L. C. V.; SILVA, R. R.; MATEUS, R. G. Suplementação a pasto: disponibilidade e qualidade x níveis de suplementação x desempenho. Revista Brasileira de Zootecnia, v.38, p.371-389, 2009 (supl especial).
SMITH B.P.; MAGDASIAN K.G. Alterations in alimentary and hepatic function. In: SMITH, B.L.; MILES, C.O. A role for Brachiaria decumbens photosensitization of ruminants. Vet. Hum. Toxicol. v.35, p.256-257, 1993
SOUZA, V.S.; BRUM, K.B.; GARUTTI, M. B.; FIORAVANTI, M.C.S.; HARAGUCHI, M. Influência da sazonalidade e pluviometria sobre a saponina esteroidal das gramíneas Brachiaria brizantha e Brachiaria decumbens em Jataí (GO). Anais Reunião Anual da Sociedade Brasileira de Química, Águas de Lindóia, SP, p.29, 2006.
STELGELMEIER, B. L. Equine photosensitization. Clinical techniques in equine practice, v.2, p. 81-88, 2002.
TENNANT, B. C. Hepatic Function In: KANEKO, J. J.; HARVEY, J. W.; BRUSS, M. L. Clinical Biochemistry of Domestic Animals. 5 ed. London Academic Press, 1997. P. 327-352.
TOKARNIA, C. H.; DÖBEREINER, J.; PEIXOTO, P. V. Plantas Tóxicas do Brasil. Helianthus: Rio de Janeiro, 2000, 310p.
WINA, E.; MUETZEL, S.; BECKER, K. The impact of saponins or saponin-containing plant materials on ruminant production – a review. Journal of Agricultural and Food Chemistry, v.53, p.8093-8105, 2005.
